La Calorimétrie
Etude de l'énergie thermique
Chapitres
• Échanges d'énergie thermique
• Variation de température lors d'un échange d'énergie
• Changement d'état lors d'un échange d'énergie
• Le calorimètre
Échanges d'énergie thermique
Définition de la chaleur
La chaleur est décrite comme quelque chose qui est chaud, la définition du Larousse donne d’ailleurs : qualité de ce qui est chaud, température, sensation que donne un corps chaud.
En physique, il s’agit d’un mode de transfert d’énergie d’un corps à l’autre (et ne correspondant pas à un travail). La thermodynamique est d’ailleurs la science qui étudie tous les phénomènes liés à la chaleur.
Energie thermique
Pour être plus précis, les physiciens ne parlent pas de chaleur mais d’énergie thermique.
L’énergie thermique échangée par un corps est notée avec la lettre Q et exprimée en Joule ou en kilojoule. Lorsqu’un corps reçoit de l’énergie thermique celle-ci est notée positive alors que s’il en cède elle est notée négative.
Par ailleurs, étant donnée que l’énergie se conserve, si un corps n°1 reçoit une énergie Q1 de la part d’un corps n°2 qui échange une énergie Q2 alors Q1 = -Q2 : les énergies échangées par les deux corps ont la même valeur absolue mais des signes opposés.
Variation de température lors d'un échange d'énergie
Unités de température
On peut utiliser plusieurs échelles de températures. Parmi les plus connues on note :
Le degré Kelvin : c’est l’unité internationale qui est utilisée en thermodynamique. Son nom vient du physicien Lord Kelvin. Le zéro du degré kelvin est définit comme le point ou il ne règne aucune agitation thermique.
Le degré Celsius : son nom provient du physicien suédois Anders Celsius et son unité est exprimée en °C. En degré celsius l’eau se transforme en glace à 0°C. C’est l’unité qui est utilisée en France pour nommer les températures.
Le degré Fahrenheit : est une unité de mesure utilisée principalement aux Etats-Unis. Son nom vient du physicien allemand Daniel Gabriel Fahrenheit.
Comment passer d’une température en Celsius en température Fahrenheit ou Kelvin ?
Pour passer des degrés Celsius aux degrés Fahrenheit, on doit multiplier par 1,8 la température et y ajouter 32. Pour passer des degrés Celsius aux degrés Kelvin, on doit ajouter aux degrés Celsius 273,15.

Différences entre degré Celsius et degré Kelvin
Note : il existe d’autres échelles de température moins connues comme par exemple les degrés Centigrades ou les degrés Rankines.
Variation de température
La variation de température d'un corps de masse m qui échange de l'énergie thermique peut être exprimée avec la relation suivante :
Q est l'énergie thermique échangée exprimée en joule ( J )
m est la masse du corps exprimée en kilogramme ( kg )
Cm est une grandeur appelée capacité thermique massique dépendant de la nature du corp. Cm est exprimée en Joule par degré celcius par kilogramme ( J.C-1.kg-1)
Tf correspond à la température finale après l'échange d'énergie exprimée en degré celcius ( °C )
Ti correspond à la température initiale avant l'échange d'énergie exprimée en degré celcius ( °C )
Remarques
Si le corps reçoit de l'énergie thermique alors Q>0 dont Tf - Ti >0 ce qui signifie que la température augmente alors que si un corps perd de l'énergie thermique Q<0 donc Tf-Ti<0 ce qui correspond à une baisse de température
Cette formule peut aussi être utilisée pour prévoir la température finale d'un corps lorsqu'on connait la valeur de l'énergie thermique échangée. Il suffit de modifier la formule pour obtenir :
Qu’est ce que la capacité thermique massique ?
La capacité thermique massique ou capacité thermique spécifique a longtemps été nommée « chaleur massique » ou encore « chaleur spécifique ». Il s’agit d’une valeur qui s’exprime en J/kg-1/K-1.
C’est la capacité d’un matériau à accumuler de l’énergie sous forme thermique, en fonction de sa masse pour une température donnée.
Le tableau ci-après regroupe quelques capacités thermiques massiques :
Changement d'état lors d'un échange d'énergie
Rappel sur les changements d’état
Il arrive qu’un transfert d’énergie thermique fasse changer l’état d’un corps.
Un corps peut se trouver sous 3 états différents : l’état liquide, l’état solide et l’état gazeux. Chaque changement d’état porte un nom bien précis :
Le passage de l’état solide à l’état liquide se nomme la fusion et à l’inverse, le passage de l’état liquide à l’état solide se nomme la solidification.
Le passage de l’état gazeux à l’état solide se nomme la condensation et à l’inverse le passage de l’état solide à l’état gazeux se nomme la sublimation.
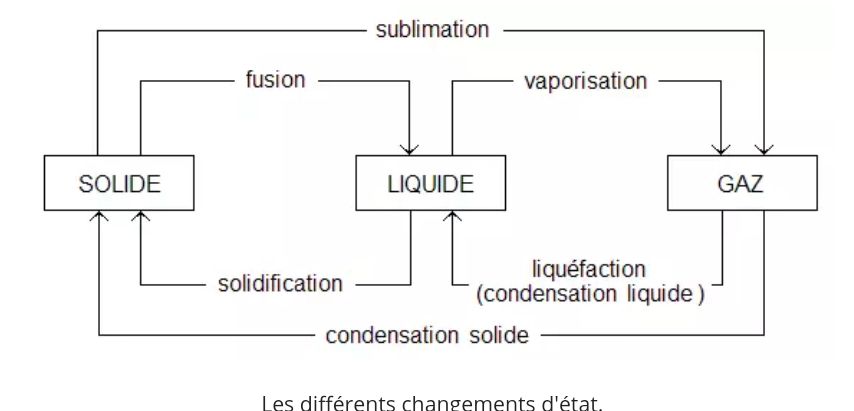
Le passage de l’état liquide à l’état gazeux se nomme se nomme la vaporisation et à l’inverse le passage de l’état gazeux à l’état liquide se nomme liquéfaction.
Les changements d’états sont résumés dans l’image qui suit :
Les différents changements d'état.
Lien entre le transfert et la masse
Lorsqu’un corps pur change d’état, sa température ne varie pas tant que le changement n’est pas terminé. La chaleur nécessaire à un changement d’état d’un corps de masse m dépend de cette masse ainsi que d’une grandeur notée Lm et appelée énergie massique de changement d’état et elle peut être calculée grâce à la relation suivante:
Q est l’énergie thermique échangée pendant un changement d’état exprimée en joule ( J)
m est la masse du corps exprimée en kilogramme ( kg )
L est l’énergie massique de changement d’état exprimée en joules par kilogramme ( J.kg-1)
Qu’est ce que Lm ou énergie massique de changement d’état ?
Cette énergie est aussi appelée chaleur latente. Voici 2 exemples :
1. Changement d'état entre un liquide et un solide : fusion-solidification
Si on place un corps solide et qu'on le chauffe jusqu'à l'amener à l'état liquide, on effectue une fusion. Durant la transformation, la température reste constante et est égale à la température de fusion (Tf) du corps en question.
La chaleur Q qu'il a fallu fournir est proportionnelle à la masse m transformée et suit bien l'équation :
Avec Q énergie thermique en Joules, m la masse en kilogrammes et Lf la chaleur latente de fusion exprimée en joules par kg.
La température de fusion dépend surtout de la nature du corps que l'on a utilisé et non des conditions expérimentales. La température de fusion exprime donc la quantité de chaleur qu'il faut fournir à une masse d'un corps pour l'amener entièrement à l'état liquide.
Note : la chaleur cédée au milieu par une masse qui se solidifie vaut
Avec Ls = -Lf avec Ls qui désigne la température de solidification.
Quelques exemples de chaleur de fusion et de température de fusion :
Aluminium : chaleur de fusion de 330 kJ.kg-1 et température de fusion de 660°C
Dioxyde de carbone : chaleur de fusion de 184 kJ.kg-1 et température de fusion de -56,6°C
Soufre : chaleur de fusion de 41,8 kJ.kg-1 et température de fusion de 115°C
Mercure : chaleur de fusion de 11,5 kJ.kg-1 et température de fusion de -38,87°C
2. Changement d'état entre un liquide et un solide : vaporisation-condensation
La vaporisation désigne le passage d'un corps de l'état liquide à l'état gazeux. Ce type de transformation peut s'effectuer de différentes manières comme par exemple l'évaporation d'un liquide laissé à l'air libre ou ébullition d'un liquide.
La chaleur latente de vaporisation Lv d'un corps à un température constante désigne la quantité de chaleur qu'il faut fournir à une unité de masse de ce corps pour le transformer entièrement en vapeur.
Ce changement d'état est noté comme tel :
Avec Q énergie thermique en Joules,
m la masse en kilogrammes
Et Lv la chaleur latente de vaporisation exprimée en joules par kg.
Le passage de l'état liquide à l'état gazeux.
A noter : la quantité de chaleur cédées au milieu extérieur par une masse m de gaz quand elle se condense à température constante équivault à :
Et Ll = Lv avec Ll qui désigne la température de solidification.
Quelques exemples de chaleur de vaporisation et de température ou point d'ébullition :
Ammoniac : chaleur de vaporisation de 1376 kJ.kg-1 et température d’ébullition de -33,35 °C
Éthanol : chaleur de vaporisation de 906 kJ.kg-1 et température d'ébullition de 78°C
Dioxygène : chaleur de vaporisation de 212,5 kJ.kg-1 et température d'ébullition de -182,9°C
Hélium : chaleur de vaporisation de 20 kJ.kg-1 et température d'ébullition de -268,9°
Applications :
On peut étudier le pouvoir calorifique d'un combustible pour savoir la quantité de chaleur obtenue par la combustion d'un kilogramme de ce combustible. Par exemple le bois a un pouvoir calorifique de 17500 kJ.kg-1 alors que le gaz naturel a un pouvoir calorifique de 37600 kJ.kg-1.
Le calorimètre
Lorsque l'on souhaite mesurer des échanges thermiques, les corps étudiés doivent être isolés, afin que l'énergie thermique ne soit pas communiquée à l'air, aux récipients et aux autres éléments.
On utilise alors un appareil appelé calorimètre qui permet non pas de supprimer totalement les échanges d'énergie avec l'extérieur mais permet de les limiter et les rend évaluables (un calorimètre possède une capacité thermique qui est connue ou qui peut être mesurée).
.❅。°❆·。*.❅· °。·❆
Yann
Fondateur de Superprof et ingénieur, nous essayons de rendre disponible la plus grande base de savoir.
Passionné par la physique-chimie et passé par la filière scientifique au lycée, je partage mes cours (après les avoir mis à jour selon le programme de l’Éducation National )
.❅。°❆·。*.❅· °。·❆
Bạn đang đọc truyện trên: Truyen247.Pro